L’évaluation de la qualité de la prise en charge par les patients eux-mêmes a toujours représenté une dimension à part entière des mesures de la qualité. Les indicateurs qui en ressortent sont classés comme une dimension de résultat, au même titre que les indicateurs d’efficacité clinique et de sécurité des soins. Ils sont le plus généralement désignés par l’expression « qualité perçue », soulignant la position particulière du patient dans l’évaluation, à savoir celle d’une personne capable d’évaluer certains éléments de sa prise en charge du fait de son expérience, mais inapte à en considérer d’autres, faute de les observer (ex. le déroulé d’une intervention chirurgicale), ou manquant d’expertise pour en juger le bien-fondé (ce dernier point étant lui-même source de discussion avec l’affirmation de la notion de « patient expert »). Ajoutons que la reconnaissance de cette évaluation par le patient s’inscrit parmi les revendications du mouvement de la démocratie sanitaire, introduisant souvent des débats sur la place qu’elle doit occuper par rapport à celles portant sur les dimensions cliniques portées par les professionnels.
Cet article vise à établir un historique des indicateurs développés dans le domaine, puis d’en faire une analyse critique. La conclusion exprime différentes perspectives sur leurs développements futurs. Cet article est fondé sur l’expérience des auteurs dans le domaine, notamment dans le cadre du projet Compaqh (Coordination de la mesure de la performance pour l’amélioration de la qualité hospitalière) qui a accompagné le ministère de la Santé et la Haute Autorité de santé (HAS) de 2003 à 2016 dans le développement des indicateurs de qualité hospitaliers, et à travers une revue de la littérature spécifique aux patient-reported outcomes en oncologie. En lien avec les recommandations Prisma (Preferred reporting items for systematic reviews and meta-analyses), la revue réalisée sur Pubmed sur les articles publiés jusqu’au 31 décembre 2018 repose sur une recherche booléenne à partir de la combinaison de mots-clés suivante : « (PROM or PREM or PRO or PRO-PM) and (Neoplasms) and (Quality indicators) ».
Histoire de la mesure de la qualité perçue par les patients
On peut situer au début des années 2000 l’émergence en France des premières mesures centrées sur la qualité perçue par les patients. Dès le début du projet national de constitution des indicateurs hospitaliers en France, le développement d’une enquête de satisfaction a été acté [1]. Cette enquête a fait l’objet de multiples travaux de validation, notamment sur la base de méthodes d’équation structurelle, qui ont conduit à sa version actuelle e-Satis [2]. Dans sa conception, elle évalue trois dimensions principales, « les soins, « la sortie », et « le confort », auxquels s’ajoutent d’autres thèmes au gré des versions. Les modalités de recueil des données (par échantillon de 120 patients dans les premières moutures) se sont heurtées à la question des canaux les plus efficaces mais aussi faisables réglementairement pour interroger les patients, l’option par remontée Internet étant désormais recommandée. Les modalités de traitement visent à exprimer des performances comparatives entre les établissements, au global et par dimensions.
Sur cette base, les évolutions de l’enquête ont introduit à partir des années 2010 des items portant sur des données factuelles relatives à des situations expérimentées par les patients plus que sur le jugement qu’ils peuvent porter sur la même situation en termes de satisfaction. Par exemple, il leur est demandé d’exprimer un avis sur le fait d’avoir été suffisamment informés en consultation plutôt qu’un degré de satisfaction sur l’information reçue. Cette introduction d’items dits d’« expérience », en complément ou en substitution d’items de « satisfaction », s’explique par le souhait de collecter une donnée plus « neutre », donc moins sujette à des biais comportementaux associés au fait de porter un jugement (crainte d’être réprimandé par la suite, subjectivité inter-individuelle variable).
Ces dernières années marquent enfin une nouvelle étape dans l’histoire des mesures de la qualité par les patients avec l’affirmation des patient-reported outcomes (résultats rapportés par les patients) (PRO). Nous gardons volontairement l’expression anglaise qui est devenue une expression commune dans le secteur de la santé en France.
L’essor des patient-reported outcomes
Les PRO sont définis par la Food and Drug Agency aux États-Unis : « Un PRO est une mesure d’une ou plusieurs caractéristiques de l’état de santé du patient exprimé directement par lui-même (autrement dit, sans l’interprétation de la réponse du patient par un médecin ou quelqu’un d’autre)1 » [3].
Ils se déclinent en :
- patient-reported outcome measures (PROM) : mesure standardisée d’un PRO obtenue directement en interrogeant le patient qui permet de donner la vision de celui-ci sur son état de santé [4] ;
- patient-reported experience measures (PREM) qui mesure la perception du patient sur son expérience de soins [5] ;
- patient-reported outcome performance measures (PRO-PM) : « Une mesure de la performance qui est basée sur des résultats rapportés par les patients, évaluée par des données recueillies sous un format de PROM, et agrégée par une entité de santé qui doit rendre des comptes » [5]. Des guides méthodologiques pour le développement des PRO-PM accompagnent ces développements [6,7].
Apparus au niveau de la recherche clinique dans le cadre des essais randomisés et du monitoring des soins, ces indicateurs s’envisagent désormais comme des mesures applicables au sein des organisations de santé. Leur essor est permis par de nouvelles formes de recueil de données à distance, et notamment au domicile du patient (ex. capteurs ou appareils connectés pour le suivi des effets de toxicité des thérapies orales en oncologie) [8]. Des résultats semblent prometteurs quant à leur utilité au niveau du suivi des patients. En 2017, une étude randomisée contrôlée a ainsi montré une association entre l’amélioration des résultats cliniques (meilleure espérance de vie) et l’utilisation de PRO pour des patients atteints de cancers métastatiques [9].
Leur émergence récente mérite de s’arrêter un peu plus en détail sur leur contenu. Ils sont évidemment variables selon le type de pathologie, mais tout en respectant les mêmes principes. Dans un premier temps sont présentées les initiatives nationales ou supranationales, pour ensuite aborder le contenu des indicateurs développés dans un cas emblématique, l’oncologie.
État des lieux des initiatives
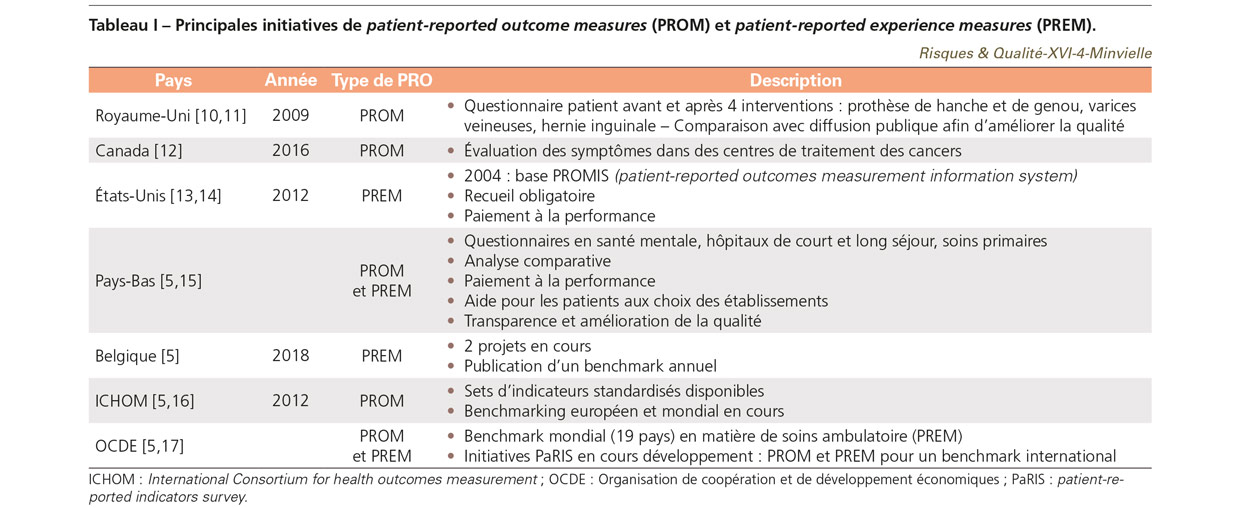
Les initiatives sont à ce jour assez peu nombreuses. Le National Health Service est le premier à avoir mis en place pour l’ensemble d’un système de soins des PROM en recueil obligatoire. Depuis le 1er avril 2009, les fournisseurs de soins réalisant les quatre interventions suivantes : prothèse de hanche, du genou, varices veineuses et hernie inguinale, doivent faire remplir aux patients un questionnaire avant et après l’intervention. Un reporting annuel des résultats est réalisé au niveau national et rendu public [10,11].
Au Canada, depuis 2016, les centres de traitement du cancer de huit provinces sur dix ont mis en place une évaluation de quatre symptômes des patients (douleur, fatigue, anxiété et dépression) à travers un PROM, l’Edmonton Symptom Assessment System Revised [12].
Aux États-Unis, depuis 2004, le National Institute of Heath a permis l’élaboration d’une base accessible sur Internet pour mesurer les principaux symptômes et critères de qualité de vie. Cet outil validé est appelé patient-reported outcomes measurement information system (PROMIS) [13]. En complément, les établissements de santé doivent depuis 2012 administrer un PREM dont le résultat est utilisé dans le système de paiement à la performance, qui comptait pour 25% du score en 2018. Ce PREM est un questionnaire soumis aux patients relatif à leur expérience à l’égard des soins de santé, le HCAHPS (Hospital consumer assessment of healthcare providers and systems) [14].
Aux Pays-Bas, dans le domaine des soins en santé mentale, les établissements doivent recueillir les PRO afin d’établir un benchmark national sur la qualité des soins [15]. Le PROM générique utilisé est le EQ-5D. Différents questionnaires PREM sont aussi mis en place dans différents types d’établissements de court ou long séjour ainsi que dans le secteur ambulatoire. Ces indicateurs poursuivent les objectifs suivants : analyse comparative, paiement à la performance, aide pour les patients au choix d’un établissement, transparence et amélioration de la qualité [5].
En Belgique, des projets existent pour favoriser l’utilisation de PREM standardisés pour permettre un benchmark et identifier les bonnes pratiques et les domaines d’actions prioritaires afin d’améliorer la prise en charge des patients et leur satisfaction. Deux projets sont en cours : ASPE (Attentes et satisfaction des patients et de leur entourage), dans lequel 17 hôpitaux participaient de manière volontaire en 2018 en faisant remplir des questionnaires à leurs patients, sept ou huit études comparatives étant produites par un bureau de conseil indépendant ; et Vlaamse Patiënten Peiling (Enquête sur les patients flamands), qui a développé des indicateurs de processus et de résultats afin d’améliorer la qualité des soins aux patients. Un questionnaire inspiré du HCAPHS américain est rempli dans les hôpitaux du nord du pays (48 établissements sur 55 en 2017), les données agrégées du benchmark étant rendues publiques. Ces données ne sont pas encore utilisées dans un système de paiement à la performance [5].
Enfin, citons deux initiatives internationales : ICHOM (International consortium for health outcomes measurement), organisme indépendant fondé en 2012 qui regroupe des hôpitaux, des instances gouvernementales et des organisations professionnelles, a pour but d’élaborer des sets d’indicateurs standardisés applicables à l’échelle mondiale pour évaluer la qualité des soins. Vingt-six sets de PROM spécifiques à une maladie ont ainsi été définis. Un projet de benchmarking entre établissements au niveau mondial, le Global health outcomes benchmarking (GLOBE) program, impliquant 35 établissements, est en cours sur la cataracte (CAT) et l’arthrose de la hanche et du genou (hip & knee osteoarthritis – HKO), ainsi qu’un projet de benchmark européen pour tester des sets d’indicateurs de résultats pour les patients relatifs aux cancers du sein et du poumon [5,16]. L’Organisation de coopération et de développement économiques (OCDE) réalise pour sa part un benchmark dans 19 pays à travers des PREM en matière de soins ambulatoires. Elle a aussi lancé l’initiative PaRIS (patient-reported indicators survey) en 2018, visant à développer des PROM et PREM pouvant faire l’objet de comparaisons internationales. Le projet a pour objectif d’accélérer et de standardiser le monitoring international de populations de patients pour lesquelles des indicateurs sont déjà utilisés (ex. patients avec une chirurgie de la hanche et du genou). Il cherche aussi à développer de nouveaux indicateurs PROM dans des domaines majeurs des soins de santé où ils n’existent pas encore (ex. maladies chroniques), en collaboration avec ICHOM et le Commonwealth Fund [5,17]. Le Tableau I résume les principales initiatives identifiées.
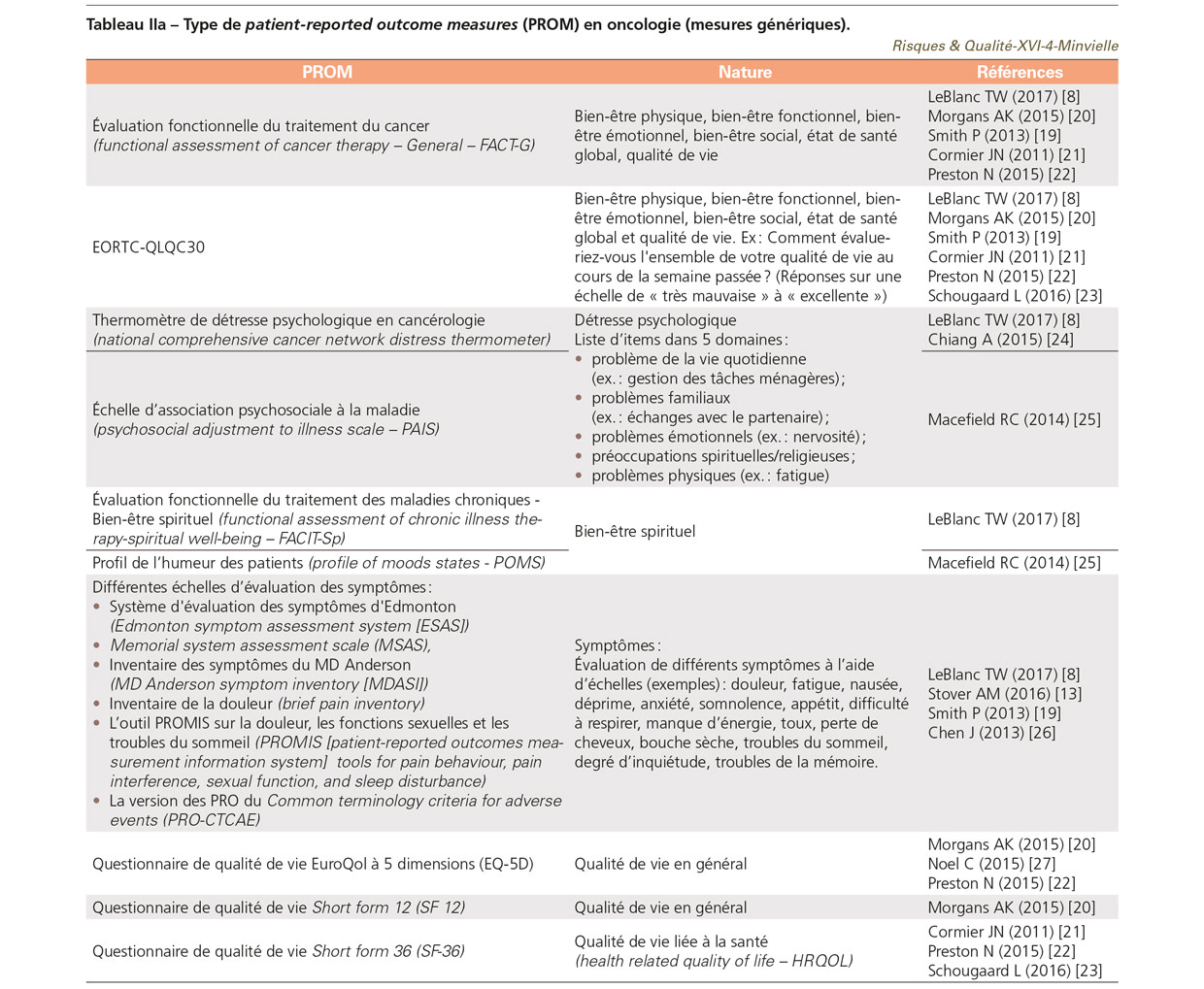
Type de patient-reported outcomes measures et patient-reported experience measures en oncologie
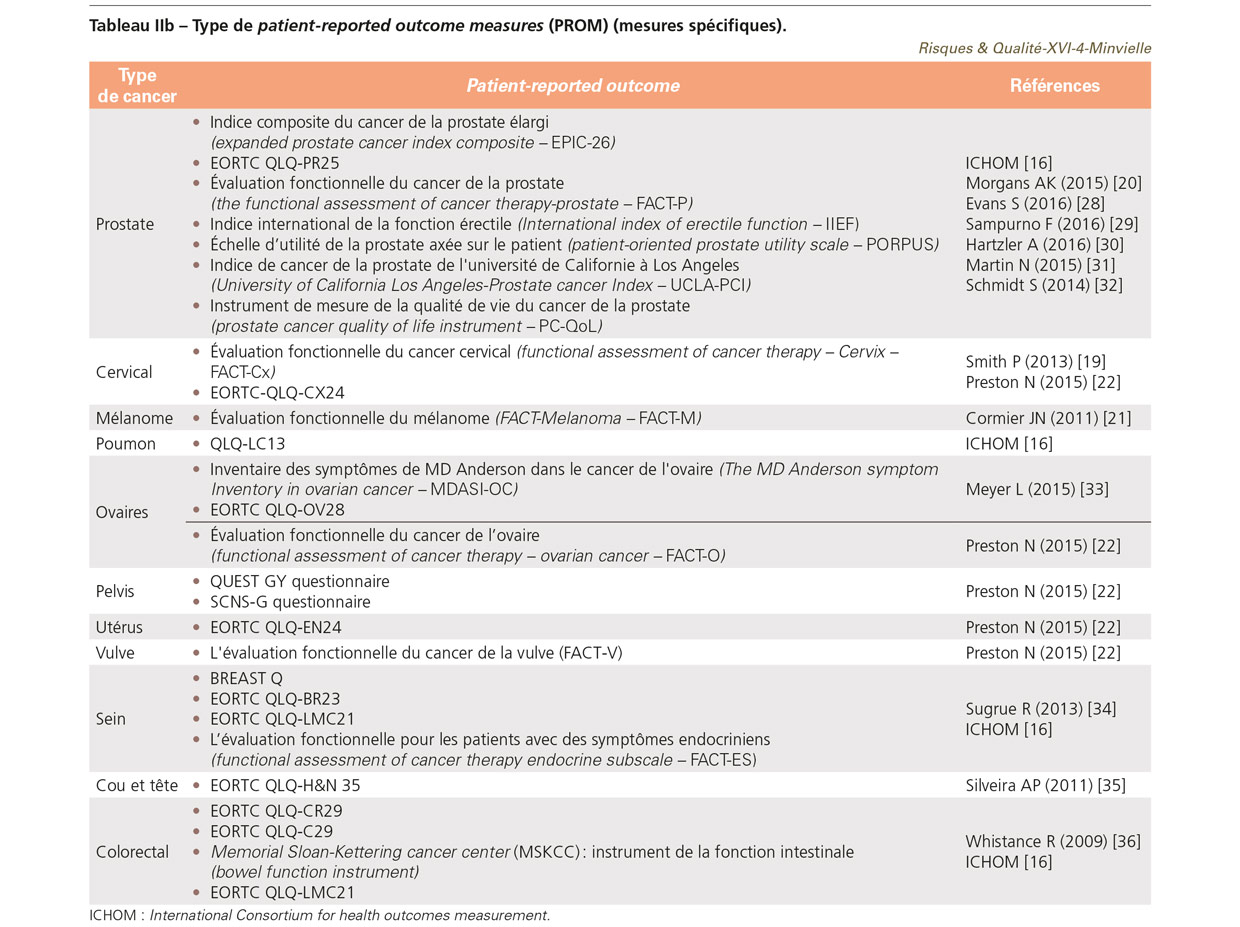
Comme dans d’autres spécialités, il existe des PROM génériques et d’autres spécifiques à un type de cancer. On entend par « mesures génériques » des questionnaires qui peuvent être utilisés pour l’ensemble des pathologies. Ceux présentés dans le TableauIIa sont les plus utilisés en oncologie, mais pourraient convenir à d’autres pathologies. Ces questionnaires explorent des questions importantes pour l’ensemble des patients : leur qualité de vie globale, les symptômes ressentis, leur état psychologique. Chaque mesure peut être multi ou uni-dimensionnelle (ex. la douleur, la fatigue) [18]. Des mesures spécifiques à différents types de cancer sont souvent associées [4,5] (Tableau IIb).
La combinaison la plus répandue de mesures génériques et spécifiques concerne les PROM génériques, Functional assessment of cancer therapy – General (FACT-G), The European organisation for research and treatment of cancer (EORTC-QLQC30) et le Short form 36 (SF-36), auxquels sont associés des modules spécifiques en fonction de la localisation de la tumeur [19].
Les PREM, comme déjà dit plus haut, s’intéressent, à la différence des PROM, à la manière dont le patient vit sa prise en charge (mesure de la satisfaction, vécu, relations avec les professionnels, etc.).
Le questionnaire de satisfaction et d’expérience e-Satis en France, le questionnaire canadien Cancer services responsiveness tool (CSR), et le HCAHPS américain sont des exemples de PREM.
L’histoire des indicateurs qualité dans le domaine marque donc une progression, des enquêtes de satisfaction vers des questionnaires mixtes de satisfaction/expérience, et désormais des PRO, PROM et PREM. Dans cette évolution, il faut noter que le passage de questionnaires d’expérience/satisfaction à PROM/PREM représente par certains aspects un habillage, car le contenu est somme toute assez proche, si ce n’est un mode de recueil plus tourné vers des supports Internet, et partant de l’expression du patient lui-même, sans intermédiaire. Par ailleurs, cette progression vers les PRO s’inscrit dans une demande double, de production d’indicateurs de résultats à des fins de régulation, comme la mise en place d’un paiement à la qualité, et de prise en compte du point de vue du patient.
Analyse critique
Les établissements et pays peuvent être confrontés à différentes difficultés lorsqu’ils souhaitent mettre en place les indicateurs de qualité décrits précédemment. Ces difficultés jalonnent les étapes de la construction de l’outil, de son administration, et de son interprétation. Nous les présentons en centrant l’analyse sur les PRO.
Choix des mesures
Le premier défi est le choix de la mesure. Il peut être difficile car il existe un grand nombre de mesures spécifiques ou génériques possibles. Dans ce contexte, on peut noter deux points particuliers [10,13] :
- La définition de l’objectif. Le choix d’un outil générique ou spécifique dépend de l’objectif et du problème traité, qu’il est important de préciser. Cela peut sembler évident, pourtant l’objectif poursuivi (suivi d’un soin, orientation sur la douleur ou la qualité de vie, analyse de l’impact d’une intervention spécifique, etc.) n’est pas toujours clairement exposé.
- La taille et la validité du questionnaire. Ces mesures sont le plus souvent rattachées à des questionnaires, dont la longueur est à limiter au risque qu’ils ne soient pas remplis. Mais il est également important de choisir des mesures fiables, ce qui suppose a contrario un minimum d’items pour une échelle donnée. D’une manière générale, les questionnaires doivent être validés sur le plan métrologique, validité de construit et de critère, reproductibilité.
Difficultés liées au recueil
À cette étape, une difficulté souvent identifiée concerne la lourdeur de la charge de travail du recueil en routine des questionnaires de satisfaction/expérience, comme des PROM/PREM. Les questionnaires peuvent être administrés aux patients par le biais de différents supports, papier ou Internet, la remontée des données devant respecter l’anonymat de leur identité. Dans tous les cas, le recueil en routine peut constituer une charge de travail importante si le système d’information n’est pas adapté, notamment en cas d’évolution vers un mode électronique [8,18,37,38], car cette évolution demande du temps, un engagement des professionnels et un soutien institutionnel qui ne sont pas toujours aisés à trouver. Outre la contrainte imposée en termes de charge de travail pour certains professionnels de santé, cette difficulté peut également se traduire par un coût élevé du recueil [3], par un biais de sélection (seuls certains patients s’expriment), ou par une limite dans la fréquence des mesures, préjudiciable dans des analyses longitudinales.
Difficultés liées au traitement des données
Le traitement des données peut se concevoir de deux manières : par comparaison inter-établissements, ou par comparaison dans le temps au niveau d’un établissement donné. Dans les deux cas, une difficulté concerne l’utilisation des résultats rapportés par les patients. Surtout dans le cas des PROM, un biais de subjectivité peut s’introduire. À état de santé constant, les patients peuvent avoir des ressentis différents (de leurs symptômes par exemple). Pour cette raison, il est préconisé depuis le début de la création de ces indicateurs de satisfaction ou d’expérience d’ajuster les résultats en fonction de trois critères : l’âge, la condition clinique, et la manière de concevoir la vie [39].
Baser la comparaison des établissements sur des PROM suppose de garantir une standardisation des modes de recueil [10,13]. Cette standardisation concerne les items du PROMS, mais aussi les trois critères propres au patient évoqués, d’autres spécificités démographiques et cliniques (état de gravité ou comorbidités, par exemple), et enfin des caractéristiques des établissements (ex. nombre de lits, milieu rural/ville) qui peuvent avoir un impact sur les résultats mesurés. Il est enfin nécessaire d’ajuster les variables correspondantes à toutes ces données afin d’assurer des comparaisons équitables. Or il n’est pas toujours certain que ces modèles d’ajustement permettent de contrôler tous les facteurs et les évolutions de la maladie qui influent sur le résultat.
Difficultés liées à la traduction en actions d’amélioration
Cette difficulté, qui traduit la capacité souvent délicate de passer d’un temps d’évaluation à un temps d’amélioration désigne souvent le caractère « actionnable » de la mesure [18].
En premier lieu, certaines mesures ne sont pas forcément aisées à décliner en termes d’actions d’amélioration. Par exemple, une comparaison inter-établissements sur un degré de fatigue de la population de patients concernée ne donne pas beaucoup de pistes d’amélioration, l’enjeu étant plutôt de situer l’évolution dans le temps.
Par ailleurs, se pose la question de la pertinence d’une analyse agrégée à partir de la moyenne. Lorsqu’un PROM est remonté par un patient, le plus important est que la donnée soit transmise à un professionnel qui puisse mettre en place une réponse adaptée. Or, lorsque l’on se situe au niveau agrégé des retours d’une population de patients, il est souvent plus difficile d’améliorer le résultat car l’analyse au niveau de chaque patient est plus compliquée à estimer à partir d’une évaluation moyenne.
Implications en termes de recommandations
En réponse aux difficultés exposées, des recommandations pour l’implantation de PROM existent [18]. Elles préconisent de : (1) faire participer les patients et les professionnels dès le début en définissant et en communiquant les objectifs de la collecte de données ; (2) choisir des mesures valides, fiables et faciles à remplir pour le patient ; (3) déterminer précisément qui remplira les mesures et à quel moment ; (4) déterminer le mode de collecte des données ; (5) s’assurer que la collecte des PROM n’a pas pour effet d’accroître la charge de travail des cliniciens ; (6) déterminer qui recevra les résultats et quand ; (7) fournir des résultats facilement interprétables par les cliniciens ; (8) s’assurer qu’une réponse est apportée suite aux remontées des patients. Des recommandations de l’OCDE sur la mise en place de PREM au niveau national [5] préconisent que : (1) les mesures soient axées sur le patient ; (2) avec des objectifs clairs ; (3) les questionnaires soient testés, validés, fiables et faisables ; (4) les questionnaires et analyses soient standardisés pour permettre les comparaisons ; (5) le système soit durable, ce qui demande un engagement des établissements et/ou de l’État et l’attribution de moyens financiers et humains.
Perspectives
Les indicateurs décrits ci-dessus se situent dans un contexte général d’évaluation et d’amélioration de la performance du système de soins. À cet égard, ils tiennent un rôle important dans la mesure de la performance hospitalière et d’autres organisations, l’une des questions étant de situer leur rôle, donc leur poids dans les mesures de la performance. Ils constituent une dimension à part entière des résultats, à coupler avec des indicateurs de processus.
Face à ce constat, deux points méritent d’être placés en perspective.
Le premier vise à prôner le développement de ces indicateurs dans l’espace du parcours, et non seulement au niveau d’une structure, en particulier l’hôpital. L’évolution du système de soins, qui met de plus en plus l’accent sur l’organisation d’un parcours, les défauts de coordination entre l’hôpital et la ville, et le lien avec le patient à distance, conduit à situer l’évaluation de la qualité perçue par les patients au niveau de cet espace. Qui mieux que le patient est apte à voir les formes de coordination mises en place pour assurer une continuité des soins, et malheureusement à en subir les défauts ou absences ? Cela suppose de développer des mesures qui couvrent cet espace, notamment dans le cas des PREM.
Le second est, en revanche, en rupture avec l’idée d’un investissement dans ces indicateurs à terme, ou du moins dans sa vision agrégée. La nécessité de tenir compte de la singularité de chaque parcours pousse idéalement à une évaluation individuelle [40]. Cette vision théorique fait désormais écho à certains développements, notamment des innovations numériques. À l’instar des avis donnés sur les sites Internet sur les hôtels et d’autres services, le développement de l’évaluation et de l’analyse de l’expérience de chaque patient fait son chemin. L’évaluation statistique « à la moyenne » que propose l’indicateur est dans ce cas dépassée et peut même révéler un décalage avec le résultat de l’expérience individuelle. Cette approche, peu développée en France, connaît déjà des applications en Grande-Bretagne, où les patients peuvent témoigner sur le site Internet du National Health Service [41]. Des contestations se font entendre sur le risque de véhiculer des jugements injustes, voire excessifs, sur des sujets sensibles. La personnalisation du suivi semble pourtant conduire à une acceptation plus large de ce type de démarche. Une méthode de recueil fondée sur des questionnaires validés, comme le préconisent les PROM et les PREM, apparaît utile dans ce contexte, mais à l’échelon du suivi individuel. C’est d’ailleurs une des utilisations les plus reconnues à l’heure actuelle dans l’emploi de ces données. Un monitoring des patients fondé sur des données propres à ceux-ci a montré des résultats importants en termes d’amélioration de la qualité des soins, notamment en oncologie.
Il apparaît donc que, si le développement des indicateurs de qualité perçus par les patients est source de revendications, notamment à travers les PROM et les PREM, il ne constitue sans doute qu’une étape vers des dispositifs plus personnalisés.
Note :
1- "A PRO is a measurement of any aspect of a patient’s health status that comes directly from the patient (i.e., without the interpretation of the patient’s responses by a physician or anyone else)". [3]